Tema 2. Las propiedades extensivas e intensivas, como una forma de identificar sustancias y materiales de uso común, así como el aprovechamiento en actividades humanas.
Aprendizaje Esperado. PDA
· Formula
hipótesis para diferenciar propiedades extensivas e intensivas, mediante
actividades experimentales y, con base en el análisis de resultados, elabora
conclusiones.
·
Reconoce
la importancia del uso de instrumentos de medición, para identificar y
diferenciar propiedades de sustancias y materiales cotidianos.
¿Cuáles son las propiedades de la materia?
Las propiedades de la materia son aquellas que definen las características de todo aquello que tiene masa y ocupa un volumen.
Es importante reconocer lo que es la propiedad de la materia, ya que está en todo lo que nos rodea. Al conocer las propiedades, podemos saber cuál es cada materia, la cantidad que hay y cómo cambia según las condiciones, entre otras cosas.
Las propiedades de la materia pueden ser generales o específicas.
Propiedades generales de la materia
Las propiedades generales de la materia son aquellas características comunes a todos los cuerpos. Por ello, son características que describen a todo tipo de sustancias, sin importar la naturaleza de las mismas. En este sentido, se conocen también como propiedades comunes o extensivas de la materia.
Las propiedades generales de la materia son:
- Masa: es la cantidad de materia que contiene un cuerpo, y se suele medir en kilogramos (kg). Por ejemplo, un kilogramo de arena tiene la misma masa que un kilogramo de aire, aunque sean partículas distintas.
- Volumen o extensión: es el espacio que ocupa un cuerpo, medido usualmente en litros (l) o metros cúbicos (m3). Un litro de agua, mercurio o metal fundido ocuparán un mismo volumen, aunque difieran en otras propiedades.
- Peso: es la fuerza que ejerce la gravedad sobre los cuerpos, expresado en Newton (N). Es una propiedad que depende de la cantidad de masa y del cuerpo que ejerce la gravedad. Un kilogramo de plomo tendrá un peso menor en la luna respecto a la Tierra, pero mayor en Júpiter.
- Porosidad: se trata del espacio que existe entre las partículas. Es una característica que cambia según la temperatura y presión, ya que cambia según el estado de agregación de la materia (sólido, líquido, gas, plasma). Aun así, toda materia contiene porosidad, sin importar su estado.
- Inercia: es la característica que impide a la materia moverse sin intervención de una fuerza externa. Cuando una fuerza externa es aplicada, la inercia implica que la materia seguirá moviéndose a menos que se apliquen otras fuerzas externas, como la fricción o el peso de otro cuerpo.
- Impenetrabilidad: es la propiedad de un cuerpo en no poder usar el espacio de otro cuerpo al mismo tiempo. Es decir, si metemos nuestra mano en un vaso de agua, la mano desplaza las partículas de agua hacia otros lados.
- Divisibilidad: es la capacidad de la materia de dividirse en partes más pequeñas. Toda sustancia puede ser cortada o separada en trozos al utilizar ciertos métodos. Un ejemplo es al romper un papel; podemos seguir rompiendo piezas de papel hasta que solo queden trozos diminutos.
Es importante recalcar que la materia y sus propiedades estarán siempre afectadas por las fuerzas gravitatorias del medio en que se encuentran y por la fuerza de atracción entre las moléculas que la componen.
Propiedades específicas de la materia
Las propiedades específicas de la materia son aquellas que diferencian un cuerpo de otro. Se agrupan en:
Propiedades físicas: son aquellas que definen la estructura medible y visible del objeto. Por lo tanto, se pueden cuantificar utilizando herramientas o identificar a través de nuestros sentidos. Algunos ejemplos de propiedades físicas son:
- El olor: cada sustancia tiene mayor o menor capacidad de emanar partículas gaseosas, y cada una provoca una sensación distinta en nuestro sentido del olfato.
- El sabor: similar al caso del olor, una sustancia determinada provocará una sensación única en nuestro sentido del gusto.
- La textura: dependiendo de la sustancia, la textura puede ser lisa, rugosa, áspera o suave.
- El estado físico: según las condiciones de temperatura, presión y el tipo de materia, el cuerpo podrá hallarse en estado sólido, líquido, gaseoso o plasmático.
- La densidad: es una propiedad que depende de cuánta masa tiene un cuerpo en un volumen específico. Mientras más masa haya en un mismo volumen, más denso será el cuerpo.
- La viscosidad: indica la resistencia en la fluidez del líquido. Es decir, si es muy viscoso, será más difícil desplazar las partículas del cuerpo aplicando fuerzas externas. Si es poco viscoso, será muy fácil desplazarlas.
- Propiedades químicas: son las propiedades que cada sustancia tiene con respecto a otras con la habilidad de crear sustancias nuevas. Algunas propiedades químicas son:
- La combustibilidad: es la capacidad de una sustancia en producir energía en forma de calor o luz en presencia de oxígeno.
- La oxidación: es una propiedad que determina cuán fácil es que la materia pierda electrones.
- La reactividad o reactividad química: es la capacidad de un cuerpo en reaccionar con otras sustancias. Una sustancia altamente reactiva reaccionará fácilmente con otras sustancias.
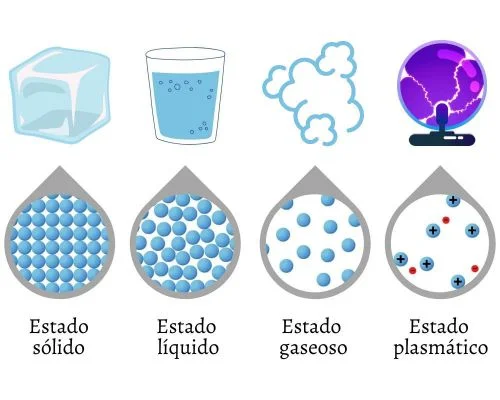
¿Cuáles son los Estados de la Materia?
Se puede considerar que existen cuatro estados físicos y fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
- Estado sólido.
- Estado líquido.
- Estado gaseoso.
- Estado plasmático.
Las características de los estados de la materia dependen de la fuerza de atracción entre las partículas y su movilidad. La temperatura y/o la presión son los factores que afectan cómo se agrupan dichas partículas y cómo interactúan entre sí.
Cuando hay alteraciones sensibles en las variables de temperatura y/o presión, se producen cambios de un estado de la materia al otro. Estos cambios son solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
Propiedad Estado
sólidoEstado
líquidoEstado
gaseosoEstado
plasmáticoTipo de materia Materia fija Fluidos con viscosidad Gases Gases calientes
(con carga eléctrica)Atracción
entre partículasAlta Intermedia Baja Baja Movilidad
de partículasBaja Intermedia Alta Alta Volumen Con volumen Con volumen Sin volumen Sin volumen Forma Definida Indefinida Indefinida Indefinida Ejemplo Piedras Agua Vapor de agua TV de plasma Estado sólido
El estado sólido es aquel que percibimos como materia fija, la cual se resiste a los cambios de forma y volumen. En la materia en estado sólido, las partículas tienen mayor atracción entre ellas, lo que reduce su movimiento y las posibilidades de interacción.
Algunos ejemplos de materia en estado sólido: rocas, madera, utensilios de metal, vidrio, hielo, grafito, ropa y granos de café.
Las características del estado sólido son:
- La fuerza de atracción entre las partículas individuales es mayor que la energía que causa separación.
- Es el estado en el que se necesita mayor cantidad de fuerza externa para separar las partículas.
- Las partículas se encierran en su posición limitando su energía vibracional.
- Mantiene su forma y volumen.
¿Cuáles son los Estados de la Materia?
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen también como estados de agregación de la materia, ya que las partículas se agregan o agrupan de maneras diferentes en cada estado.
Se puede considerar que existen cuatro estados físicos y fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
- Estado sólido.
- Estado líquido.
- Estado gaseoso.
- Estado plasmático.
En el detalle de la imagen, observamos cómo se agrupan las partículas.
Sin embargo, los estudios sobre los estados de agregación de la materia se han extendido en la actualidad. Además de aquellos que se presentan naturalmente, hoy se estudian aquellos que se presentan en condiciones extremas, inducidas en laboratorio. De este grupo, los científicos han comprobado la existencia de tres nuevos estados: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Las características de los estados de la materia dependen de la fuerza de atracción entre las partículas y su movilidad. La temperatura y/o la presión son los factores que afectan cómo se agrupan dichas partículas y cómo interactúan entre sí.
Cuando hay alteraciones sensibles en las variables de temperatura y/o presión, se producen cambios de un estado de la materia al otro. Estos cambios son solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
A continuación, presentamos un cuadro comparativo con las principales características y diferencias que existen entre los estados fundamentales de la materia:
Propiedad Estado
sólidoEstado
líquidoEstado
gaseosoEstado
plasmáticoTipo de materia Materia fija Fluidos con viscosidad Gases Gases calientes
(con carga eléctrica)Atracción
entre partículasAlta Intermedia Baja Baja Movilidad
de partículasBaja Intermedia Alta Alta Volumen Con volumen Con volumen Sin volumen Sin volumen Forma Definida Indefinida Indefinida Indefinida Ejemplo Piedras Agua Vapor de agua TV de plasma Estado sólido
El estado sólido es aquel que percibimos como materia fija, la cual se resiste a los cambios de forma y volumen. En la materia en estado sólido, las partículas tienen mayor atracción entre ellas, lo que reduce su movimiento y las posibilidades de interacción.
Algunos ejemplos de materia en estado sólido: rocas, madera, utensilios de metal, vidrio, hielo, grafito, ropa y granos de café.
Las características del estado sólido son:
- La fuerza de atracción entre las partículas individuales es mayor que la energía que causa separación.
- Es el estado en el que se necesita mayor cantidad de fuerza externa para separar las partículas.
- Las partículas se encierran en su posición limitando su energía vibracional.
- Mantiene su forma y volumen.
Estado líquido
El estado líquido corresponde a los fluidos cuyo volumen es constante, pero se adapta a la forma de su contenedor. Pueden tener un nivel de viscosidad variable, dependiendo de los elementos en los que se compone el líquido.
Algunos ejemplos de materia en estado líquido son: agua, bebidas refrigerantes, lava, mercurio a temperatura ambiente, aceite y saliva.
Las características del estado líquido son:
- Las partículas se atraen entre sí, pero la distancia es mayor que en los sólidos.
- Las partículas son más dinámicas que los sólidos, pero más estables que los gases.
- Tiene un volumen constante.
- Su forma es indefinida. Por ende, el líquido toma la forma de su contenedor.
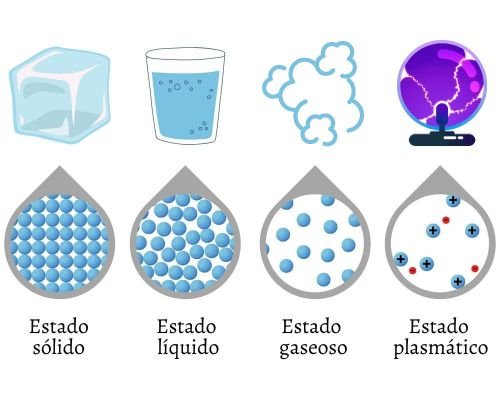
¿Cuáles son los Estados de la Materia?
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen también como estados de agregación de la materia, ya que las partículas se agregan o agrupan de maneras diferentes en cada estado.
Se puede considerar que existen cuatro estados físicos y fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
- Estado sólido.
- Estado líquido.
- Estado gaseoso.
- Estado plasmático.

En el detalle de la imagen, observamos cómo se agrupan las partículas.
Sin embargo, los estudios sobre los estados de agregación de la materia se han extendido en la actualidad. Además de aquellos que se presentan naturalmente, hoy se estudian aquellos que se presentan en condiciones extremas, inducidas en laboratorio. De este grupo, los científicos han comprobado la existencia de tres nuevos estados: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Las características de los estados de la materia dependen de la fuerza de atracción entre las partículas y su movilidad. La temperatura y/o la presión son los factores que afectan cómo se agrupan dichas partículas y cómo interactúan entre sí.
Cuando hay alteraciones sensibles en las variables de temperatura y/o presión, se producen cambios de un estado de la materia al otro. Estos cambios son solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
A continuación, presentamos un cuadro comparativo con las principales características y diferencias que existen entre los estados fundamentales de la materia:
Propiedad Estado
sólidoEstado
líquidoEstado
gaseosoEstado
plasmáticoTipo de materia Materia fija Fluidos con viscosidad Gases Gases calientes
(con carga eléctrica)Atracción
entre partículasAlta Intermedia Baja Baja Movilidad
de partículasBaja Intermedia Alta Alta Volumen Con volumen Con volumen Sin volumen Sin volumen Forma Definida Indefinida Indefinida Indefinida Ejemplo Piedras Agua Vapor de agua TV de plasma Estado sólido
El estado sólido es aquel que percibimos como materia fija, la cual se resiste a los cambios de forma y volumen. En la materia en estado sólido, las partículas tienen mayor atracción entre ellas, lo que reduce su movimiento y las posibilidades de interacción.
Algunos ejemplos de materia en estado sólido: rocas, madera, utensilios de metal, vidrio, hielo, grafito, ropa y granos de café.
Las características del estado sólido son:
- La fuerza de atracción entre las partículas individuales es mayor que la energía que causa separación.
- Es el estado en el que se necesita mayor cantidad de fuerza externa para separar las partículas.
- Las partículas se encierran en su posición limitando su energía vibracional.
- Mantiene su forma y volumen.
Estado líquido
El estado líquido corresponde a los fluidos cuyo volumen es constante, pero se adapta a la forma de su contenedor. Pueden tener un nivel de viscosidad variable, dependiendo de los elementos en los que se compone el líquido.
Algunos ejemplos de materia en estado líquido son: agua, bebidas refrigerantes, lava, mercurio a temperatura ambiente, aceite y saliva.
Las características del estado líquido son:
- Las partículas se atraen entre sí, pero la distancia es mayor que en los sólidos.
- Las partículas son más dinámicas que los sólidos, pero más estables que los gases.
- Tiene un volumen constante.
- Su forma es indefinida. Por ende, el líquido toma la forma de su contenedor.
Estado gaseoso
El estado gaseoso corresponde a los gases. Técnicamente se define como el agrupamiento de partículas con poca atracción entre sí que, al chocar unas con otras, se expanden en el espacio.
Algunos ejemplos de materia en estado gaseoso son: vapor de agua, oxígeno (O2), helio (He), el aroma de los perfumes, humo, el aire atmosférico y gas natural.
Las características del estado gaseoso son:
- La concentración de partículas en un mismo espacio es menor que la de los sólidos y los líquidos.
- Las partículas tienen poca atracción entre sí.
- Las partículas se encuentran en expansión, por lo cual son más dinámicas que los sólidos y los gases.
- No tiene forma ni volumen definido.
¿Cuáles son los Estados de la Materia?
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen también como estados de agregación de la materia, ya que las partículas se agregan o agrupan de maneras diferentes en cada estado.
Se puede considerar que existen cuatro estados físicos y fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
- Estado sólido.
- Estado líquido.
- Estado gaseoso.
- Estado plasmático.

En el detalle de la imagen, observamos cómo se agrupan las partículas.
Sin embargo, los estudios sobre los estados de agregación de la materia se han extendido en la actualidad. Además de aquellos que se presentan naturalmente, hoy se estudian aquellos que se presentan en condiciones extremas, inducidas en laboratorio. De este grupo, los científicos han comprobado la existencia de tres nuevos estados: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Las características de los estados de la materia dependen de la fuerza de atracción entre las partículas y su movilidad. La temperatura y/o la presión son los factores que afectan cómo se agrupan dichas partículas y cómo interactúan entre sí.
Cuando hay alteraciones sensibles en las variables de temperatura y/o presión, se producen cambios de un estado de la materia al otro. Estos cambios son solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
A continuación, presentamos un cuadro comparativo con las principales características y diferencias que existen entre los estados fundamentales de la materia:
Propiedad Estado
sólidoEstado
líquidoEstado
gaseosoEstado
plasmáticoTipo de materia Materia fija Fluidos con viscosidad Gases Gases calientes
(con carga eléctrica)Atracción
entre partículasAlta Intermedia Baja Baja Movilidad
de partículasBaja Intermedia Alta Alta Volumen Con volumen Con volumen Sin volumen Sin volumen Forma Definida Indefinida Indefinida Indefinida Ejemplo Piedras Agua Vapor de agua TV de plasma Estado sólido
El estado sólido es aquel que percibimos como materia fija, la cual se resiste a los cambios de forma y volumen. En la materia en estado sólido, las partículas tienen mayor atracción entre ellas, lo que reduce su movimiento y las posibilidades de interacción.
Algunos ejemplos de materia en estado sólido: rocas, madera, utensilios de metal, vidrio, hielo, grafito, ropa y granos de café.
Las características del estado sólido son:
- La fuerza de atracción entre las partículas individuales es mayor que la energía que causa separación.
- Es el estado en el que se necesita mayor cantidad de fuerza externa para separar las partículas.
- Las partículas se encierran en su posición limitando su energía vibracional.
- Mantiene su forma y volumen.
Estado líquido
El estado líquido corresponde a los fluidos cuyo volumen es constante, pero se adapta a la forma de su contenedor. Pueden tener un nivel de viscosidad variable, dependiendo de los elementos en los que se compone el líquido.
Algunos ejemplos de materia en estado líquido son: agua, bebidas refrigerantes, lava, mercurio a temperatura ambiente, aceite y saliva.
Las características del estado líquido son:
- Las partículas se atraen entre sí, pero la distancia es mayor que en los sólidos.
- Las partículas son más dinámicas que los sólidos, pero más estables que los gases.
- Tiene un volumen constante.
- Su forma es indefinida. Por ende, el líquido toma la forma de su contenedor.
Estado gaseoso
El estado gaseoso corresponde a los gases. Técnicamente se define como el agrupamiento de partículas con poca atracción entre sí que, al chocar unas con otras, se expanden en el espacio.
Algunos ejemplos de materia en estado gaseoso son: vapor de agua, oxígeno (O2), helio (He), el aroma de los perfumes, humo, el aire atmosférico y gas natural.
Las características del estado gaseoso son:
- La concentración de partículas en un mismo espacio es menor que la de los sólidos y los líquidos.
- Las partículas tienen poca atracción entre sí.
- Las partículas se encuentran en expansión, por lo cual son más dinámicas que los sólidos y los gases.
- No tiene forma ni volumen definido.
¿Cuáles son los Estados de la Materia?
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen también como estados de agregación de la materia, ya que las partículas se agregan o agrupan de maneras diferentes en cada estado.
Se puede considerar que existen cuatro estados físicos y fundamentales de la materia, tomando en cuenta aquellas formas de agregación que se presentan bajo condiciones naturales. Los estados fundamentales de la materia son:
- Estado sólido.
- Estado líquido.
- Estado gaseoso.
- Estado plasmático.

En el detalle de la imagen, observamos cómo se agrupan las partículas.
Sin embargo, los estudios sobre los estados de agregación de la materia se han extendido en la actualidad. Además de aquellos que se presentan naturalmente, hoy se estudian aquellos que se presentan en condiciones extremas, inducidas en laboratorio. De este grupo, los científicos han comprobado la existencia de tres nuevos estados: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Las características de los estados de la materia dependen de la fuerza de atracción entre las partículas y su movilidad. La temperatura y/o la presión son los factores que afectan cómo se agrupan dichas partículas y cómo interactúan entre sí.
Cuando hay alteraciones sensibles en las variables de temperatura y/o presión, se producen cambios de un estado de la materia al otro. Estos cambios son solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
A continuación, presentamos un cuadro comparativo con las principales características y diferencias que existen entre los estados fundamentales de la materia:
Propiedad Estado
sólidoEstado
líquidoEstado
gaseosoEstado
plasmáticoTipo de materia Materia fija Fluidos con viscosidad Gases Gases calientes
(con carga eléctrica)Atracción
entre partículasAlta Intermedia Baja Baja Movilidad
de partículasBaja Intermedia Alta Alta Volumen Con volumen Con volumen Sin volumen Sin volumen Forma Definida Indefinida Indefinida Indefinida Ejemplo Piedras Agua Vapor de agua TV de plasma Estado sólido
El estado sólido es aquel que percibimos como materia fija, la cual se resiste a los cambios de forma y volumen. En la materia en estado sólido, las partículas tienen mayor atracción entre ellas, lo que reduce su movimiento y las posibilidades de interacción.
Algunos ejemplos de materia en estado sólido: rocas, madera, utensilios de metal, vidrio, hielo, grafito, ropa y granos de café.
Las características del estado sólido son:
- La fuerza de atracción entre las partículas individuales es mayor que la energía que causa separación.
- Es el estado en el que se necesita mayor cantidad de fuerza externa para separar las partículas.
- Las partículas se encierran en su posición limitando su energía vibracional.
- Mantiene su forma y volumen.
Estado líquido
El estado líquido corresponde a los fluidos cuyo volumen es constante, pero se adapta a la forma de su contenedor. Pueden tener un nivel de viscosidad variable, dependiendo de los elementos en los que se compone el líquido.
Algunos ejemplos de materia en estado líquido son: agua, bebidas refrigerantes, lava, mercurio a temperatura ambiente, aceite y saliva.
Las características del estado líquido son:
- Las partículas se atraen entre sí, pero la distancia es mayor que en los sólidos.
- Las partículas son más dinámicas que los sólidos, pero más estables que los gases.
- Tiene un volumen constante.
- Su forma es indefinida. Por ende, el líquido toma la forma de su contenedor.
Estado gaseoso
El estado gaseoso corresponde a los gases. Técnicamente se define como el agrupamiento de partículas con poca atracción entre sí que, al chocar unas con otras, se expanden en el espacio.
Algunos ejemplos de materia en estado gaseoso son: vapor de agua, oxígeno (O2), helio (He), el aroma de los perfumes, humo, el aire atmosférico y gas natural.
Las características del estado gaseoso son:
- La concentración de partículas en un mismo espacio es menor que la de los sólidos y los líquidos.
- Las partículas tienen poca atracción entre sí.
- Las partículas se encuentran en expansión, por lo cual son más dinámicas que los sólidos y los gases.
- No tiene forma ni volumen definido.
Estado plasmático
El estado plasmático es un estado semejante al gaseoso, pero posee partículas cargadas eléctricamente, es decir, ionizadas. Se trata, pues, de gases calientes.
La materia en estado plasmático es muy común en el espacio sideral y constituye, de hecho, el 99% de su materia observable. Sin embargo, el estado plasmático también se reproduce naturalmente en algunos fenómenos terrestres. Asimismo, se puede producir artificialmente para diversos usos.
Por ejemplo, hay plasma en el sol, las estrellas y las nebulosas. También está presente en las auroras polares, en los rayos y en el llamado Fuego de San Telmo. En cuanto a su producción artificial, algunos ejemplos son los televisores de plasma, los tubos fluorescentes y las lámparas de plasma.
Las características del estado plasmático son:
- Carece de forma y volumen definidos.
- Sus partículas están ionizadas.
- Carece de equilibrio electromagnético.
- Es buen conductor eléctrico.
- Forma filamentos, capas y rayos cuando se expone a un campo magnético.
Cambios de estados de la materia
Los cambios de estados de la materia son procesos que permiten que la estructura espacial de la materia cambie de un estado a otro. Dependen de las variaciones en las condiciones ambientales como la temperatura y/o la presión.
Tomando en cuenta los estados fundamentales de materia, los cambios de estado de la materia son: solidificación, vaporización, fusión, sublimación, sublimación inversa, ionización y desionización.
- Fusión o derretimiento. Es el cambio del estado sólido al estado líquido. Se produce cuando el sólido se expone a temperaturas más elevadas que su punto de fusión. Ocurre porque las altas temperaturas a las que se somete el sólido hace que las partículas se separen más y se muevan con más facilidad.
- Solidificación. La solidificación es el cambio del estado líquido al estado sólido. Cuando la temperatura de un líquido desciende, las partículas comienzan a aproximarse entre sí y se reduce el movimiento entre ellas. Al llegar al punto de congelación, se convierten en materia sólida.
- Vaporización. La vaporización es el cambio del estado líquido al estado gaseoso. Ocurre cuando se eleva la temperatura hasta llegar al punto de ebullición, rompiendo la atracción entre las partículas. Esto ocasiona su separación y el aumento de su movimiento, dando lugar a un gas.
- Condensación. La condensación es el cambio del estado gaseoso al estado líquido. Al bajar la temperatura y/o subir la presión, las partículas del gas pierden alguna movilidad y se aproximan entre sí. Esta aproximación explica el paso del gas al líquido.
- Sublimación. La sublimación es el cambio del estado sólido al estado gaseoso sin pasar por el estado líquido. Se produce, por ejemplo, en las esferas de naftalina. Estas esferas que se usan para alejar las polillas de los armarios tienen la propiedad de evaporarse con el tiempo, sin entrar en un estado líquido.
- Sublimación inversa. Se llama sublimación inversa, sublimación regresiva, deposición o cristalización al cambio del estado gaseoso al sólido de manera directa. Lo que ocurre aquí es que un gas se solidifica de forma inmediata, sin entrar en un estado líquido.
- Ionización. La ionización es el cambio de gas a plasma, el cual se produce cuando las partículas del gas son cargadas eléctricamente. Esto es posible cuando se calienta un gas.
- Desionización. La desionización consiste en el paso del estado plasmático al estado gaseoso. Se trata, pues, del proceso contrario a la ionización.
A continuación, presentamos una tabla que resume los cambios de la materia y expone un ejemplo por cada uno.
Proceso Cambio de estado Ejemplo Fusión Sólido a líquido. Deshielos. Líquido a sólido. Agua a hielo. Vaporización Líquido a gaseoso. Agua a vapor de agua. Condensación Gaseoso a líquido. Lluvia. Sublimación Sólido a gaseoso. Hielo seco. Sublimación inversa Gaseoso a sólido. Vapor de agua a nieve. Ionización Gaseoso a plasmático. Letreros de neón. Desionización Plasmático a gaseoso. El humo que resulta al
apagar una llama.