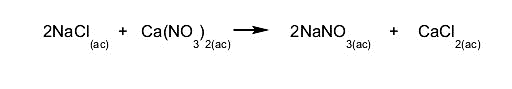Identificación de cambios químicos y el lenguaje de la química• Manifestaciones y representación de reacciones químicas (ecuación química).
Aprendizajes
Esperados: •
Describe algunas manifestaciones de cambios químicos sencillos (efervescencia,
emisión de luz o calor, precipitación, cambio de color).
•
Identifica las propiedades de los reactivos y los productos en una reacción
química.
•
Representa el cambio químico mediante una ecuación e interpreta la información
que contiene.
•
Verifica la correcta expresión de ecuaciones químicas sencillas con base en la
Ley de conservación de la masa.
•
Identifica que en una reacción química se absorbe o se desprende energía en
forma de calor.
Un cambio implica una alteración,
modificación o transformación. Químico, por su parte, es aquello vinculado
a las propiedades y la estructura de una sustancia según su composición.
Se
llama cambio químico al proceso que
lleva a una o más sustancias (denominadas reactivos) a modificar su
estructura y los enlaces de sus moléculas, convirtiéndose en otras sustancias
que reciben el nombre de productos. Estos cambios se pueden representar de
manera simbólica mediante ecuaciones químicas.
Cambios
químicos: Son
aquellos en los que unas sustancias se transforman en otras sustancias
diferentes, con naturaleza y propiedades distintas. Por ejemplo, se producen
cambios químicos cuando una sustancia arde, se oxida o se descompone.
Cambios
físicos: Son
todos aquellos en los que ninguna sustancia se transforma en otra diferente.
Por ejemplo se producen cambios físicos cuando una sustancia se mueve, se le
aplica una fuerza o se deforma.
Tipos
de cambios químicos
A
grandes rasgos, podemos decir que existen dos tipos de cambios químicos: los
inorgánicos y los orgánicos. Con respecto a la química orgánica,
hay dos modelos en los cuales se dividen los cambios, según afecten los estados
de oxidación: las reacciones redox sí los afectan, mientras
que las de neutralización, no.
Otra
clasificación posible para los cambios de estado tiene en cuenta el tipo
de estructura, y de
allí surgen los siguientes:
*
de síntesis:
también se denomina de combinación ya que en él se combinan
los reactivos entre sí para dar lugar al origen de un nuevo producto;
*
de descomposición simple: cuando se produce el desdoblamiento de una
sustancia en sus componentes;
*
de descomposición por medio de un reactivo: para que tenga lugar la
descomposición de una sustancia, es necesario el uso de un reactivo;
*
de sustitución:
algún componente de los reactivos es sustituido por una sustancia, de forma tal
que el primero quede en libertad. Este tipo de cambio químico también se
denomina de desplazamiento;
*
de doble sustitución:
también se llama de doble desplazamiento, y tiene lugar cuando los
elementos o los grupos de elementos que participan en el cambio químico se
intercambian.
De
acuerdo con el tipo de energía que
se intercambia:
*
en forma de calor:
en este grupo entran las reacciones exotérmicas, cuando el sistema
de reacción desprende calor, y las endotérmicas, el calor es
necesario para que tenga lugar el cambio químico;
*
en forma de luz:
las reacciones endoluminosas necesitan luz del exterior
mientras que las exoluminosas la emiten;
*
en forma de electricidad: las reacciones endoeléctricas exigen
el aporte de electricidad,
pero las exoeléctricas la producen.
Por
último se encuentra la clasificación de acuerdo con la clase de partículas que
se intercambian, que pueden ser protones (en las reacciones ácido-base)
o electrones (en las oxidación-reducción).
En
la química orgánica tenemos
cambios químicos en los que intervienen compuestos tales como alcoholes,
cetonas, aldehídos, alcanos y alquinos, entre otros, los cuales hallan en el
grupo funcional que poseen su clasificación, sus propiedades químicas y su
reactividad. Un grupo funcional es uno o más átomos que se
encuentran unidos a una cadena carbonada.
Compuesto
químico
Un
compuesto químico es cualquier sustancia formada por la unión de dos o
más tipos de elementos químicos, o sea, por átomos de dos o más tipos
diferentes de elementos
químicos, unidos entre sí por enlaces químicos de alguna
clase.
Un compuesto químico no puede ser separado en los elementos que lo constituyen
mediante métodos físicos (destilación, decantación , etc). La única
forma de separar un compuesto químico en sus elementos constitutivos es
mediante reacciones
químicas.
El
nivel de complejidad de un compuesto químico puede ser muy sencillo o muy
complejo, esto depende de la cantidad de átomos que lo formen y la manera en
que se combinen. Existen compuestos formados por unos pocos átomos y compuestos
formados por cientos de átomos enlazados y ocupando posiciones muy específicas
en el compuesto.
Por
ejemplo, son compuestos químicos sustancias binarias como el dióxido de carbono (CO2)
o el agua (H2O).
También lo son otras más complejas como el ácido sulfúrico (H2SO4)
o la glucosa (C6H12O6), o incluso macromoléculas inexpresables
en una fórmula química simple, como una molécula de ADN humano.
Elementos químicos y compuestos químicos
Los
elementos químicos son los diferentes tipos de átomos que componen la
materia, y que se distinguen entre sí según la configuración particular de
sus partículas
subatómicas (protones, neutrones y electrones).
Los
elementos químicos se pueden agrupar de acuerdo a sus propiedades
químicas, o sea, a las fuerzas a las que responden con mayor o menor
facilidad, al comportamiento que exhiben en determinadas reacciones, o a otros
rasgos propios estructurales. Están representados, clasificados y organizados
en la Tabla Periódica de
los elementos.
Los
compuestos químicos son combinaciones de elementos químicos de distinta
complejidad. Los elementos químicos son las piezas mínimas de la materia, que no pueden ser
descompuestas en piezas menores por métodos físicos (es necesario
recurrir a los métodos químicos para esto).
Un
ejemplo de compuesto químico es el agua. Este compuesto está formado por
hidrógeno y oxígeno. Si se logra descomponer la molécula de agua, el oxígeno y
el hidrógeno puro existen en sus formas moleculares en estado gaseoso O2 y
H2.
Ecuación
química
Una
ecuación química es la forma de describir lo que ocurre en una reacción
química.
La
ecuación química sirve para representar lo que pasa cuando unos materiales se
transforman en otros a través de una reacción química.
La
información que contiene la ecuación química nos permite determinar cuáles son
los compuestos o átomos iniciales (también llamados reactantes) y
lo que se obtiene después de la reacción (es decir, el producto).
Por ejemplo, la siguiente ecuación química se lee el zinc (Zn) más azufre (S)
forman sulfuro de zinc (ZnS).
Para
escribir una ecuación química tenemos que conocer los símbolos de los elementos
químicos y la fórmula química de los compuestos.
Además,
la ecuación química tiene que cumplir con una importante ley de la química: la
ley de la conservación de la materia. Esta ley dice que la materia no se crea
ni se destruye, sino que se transforma.
Por
eso la ecuación química debe estar balanceada, es decir, la cantidad de átomos
de un lado de la flecha debe ser igual a la cantidad de átomos del otro lado de
la flecha. A esto se le llama balanceo de las ecuaciones químicas.
Partes
de una ecuación química
La
ecuación química presenta los siguientes componentes esenciales:
- Reactantes: son los
materiales iniciales antes de la reacción.
- Productos: son los
materiales que resultan de la reacción química.
- Flecha
"→":
se coloca entre los reactantes y los productos y significa
"produce"
¿Qué son las sustancias químicas?
Se
entiende por sustancia química o especie química a un tipo de materia que es químicamente
homogénea y definida, o sea, que posee una composición química fija.
Tienen la característica de que sus partículas no
pueden separarse mediante ningún mecanismo físico. Sin embargo, pueden
sufrir cambios físicos, químicos o físicoquímicos
cuando se las somete a las condiciones o reacciones apropiadas.
Los
cambios dependen de la naturaleza de la sustancia, y pueden consistir en
cambios de estado de
agregación (como enfriar agua líquida hasta obtener hielo sólido), o
transformaciones en su composición química (como la reacción entre un ácido y un álcali). En el
último caso se convierten en otra sustancia.
Tipos de sustancias químicas
Las
sustancias químicas pueden ser de dos tipos:
- Sustancias
simples. Están
compuestas por un número determinado de moléculas de un
mismo elemento
químico. Por ejemplo: la molécula de oxígeno (O2).
- Sustancias
compuestas. Se componen de dos o más elementos químicos,
que forman una estructura estable y fija. Usualmente se los conoce como “compuestos químicos”.
Por ejemplo: la molécula de agua (H2O).
Sustancias químicas peligrosas
Las
sustancias químicas poseen propiedades particulares, dependiendo de su
naturaleza y su composición. Esto a menudo puede representar un riesgo químico para la
salud de los seres humanos, animales o plantas.
La
gravedad de dicho daño dependerá de la naturaleza de la sustancia, de su concentración
y del tiempo de exposición, así como de la vía de contacto. No es lo mismo, por
ejemplo, quemarse la piel con un ácido, que ingerirlo y provocar graves daños
al sistema digestivo.
A
grandes rasgos, algunas de las sustancias químicas peligrosas pueden ser:
- Sustancias
inflamables. Sustancias
capaces de producir grandes cantidades de calor, es decir, que pueden desatar
incendios, una vez que se encuentren con el reactivo adecuado o bajo
ciertas condiciones de temperatura y presión. Por ejemplo: gas
butano.
- Sustancias
explosivas. Sustancias
que, en presencia de ciertos elementos o frente a movimientos repentinos
que ocasionen la pérdida momentánea de su estabilidad, reaccionan exotérmicamente, o
sea, generan grandes y repentinas cantidades de calor y energía, y pueden quemar y/o
violentar lo que se halle a su alrededor. Por ejemplo: nitroglicerina.
- Sustancias
corrosivas. Sustancias
de pH extremo (básico o ácido) que en
contacto con la materia
orgánica ocasionan reacciones exotérmicas focalizadas, y producen
quemaduras químicas, o en casos extremos desintegran la materia orgánica
que toquen. También pueden afectar la materia inorgánica. Por
ejemplo: ácido
sulfúrico.
- Sustancias tóxicas. Sustancias
que reaccionan de manera nociva con las sustancias que componen el cuerpo humano, de los animales y
las plantas, desencadenando reacciones que atentan contra la estabilidad
de la vida, o sea, provocando
envenenamiento. Dependiendo de la sustancia y la concentración, el nivel
de daño puede ser focalizado o general, inmediato o paulatino, y puede
contrarrestarse mediante un antídoto, o no. Por ejemplo: arsénico.
- Sustancias
radiactivas. Sustancias
cuyos átomos tienen núcleos inestables. Estas sustancias emiten radiación
ionizante como partículas alfa y beta, rayos gamma o neutrones libres. La
radiación ionizante altera la constitución química de las sustancias
químicas que entran en contacto con ella. Las sustancias radiactivas son
capaces de contaminar a los seres
vivos y de causarles no solo quemaduras, sino mutaciones genéticas
impredecibles, o incluso la muerte.
Por ejemplo: uranio-235.
- Sustancias
carcinógenas. Sustancias
que una vez introducidas al organismo,
desencadenan la reproducción desordenada
de ciertas células, es
decir, causan cáncer. Por ejemplo: benceno.
- Sustancias
mutagénicas. Sustancias
que alteran directamente el ADN de
los seres vivos, desatando mutaciones impredecibles que pueden derivar en
numerosas enfermedades, e incluso transmitirse a la descendencia. Por
ejemplo: formaldehído.
¿Qué es una fórmula química?
Una
fórmula química es una expresión gráfica de los elementos que componen
un compuesto químico cualquiera.
Las fórmulas expresan los números y las proporciones de sus átomos respectivos y, en muchos
casos, también el tipo de enlaces
químicos que los unen. A cada molécula y/o compuesto conocido
le corresponde una fórmula química, así como un nombre a partir de ella de
acuerdo a las reglas de la nomenclatura química.
Existen diversos tipos de fórmulas químicas, cada uno enfocado en cierto tipo
de información, pero en líneas generales todas sirven para comprender
la naturaleza química de las sustancias y para
expresar lo que ocurre durante una reacción química determinada,
en la que algunos elementos o compuestos se
transforman en otros. Por esa razón, las fórmulas químicas responden a un sistema
convencional de representación de los elementos y las moléculas, es decir, a un lenguaje
técnico especializado.
Las
fórmulas químicas utilizan los símbolos químicos de los elementos y
proporciones lógicas entre ellos, expresados mediante símbolos matemáticos.
Símbolos químicos
Los
símbolos químicos son las piezas mínimas que componen a una fórmula
química cualquiera y representan a cada uno de los diversos elementos
químicos conocidos por la humanidad,
o sea, los distintos tipos de átomos de los que está compuesta la materia
conocida.
A
cada elemento químico le corresponde un símbolo químico particular (generalmente
derivado de su nombre histórico en latín). Los elementos químicos son
los diferentes tipos de átomos que componen la materia y que se distinguen
entre sí según la configuración particular de sus partículas subatómicas (protones, neutrones y electrones).
Los
elementos se pueden agrupar de acuerdo a sus propiedades químicas,
o sea, a las fuerzas a las que responden con mayor o menor facilidad, al
comportamiento que exhiben en determinadas reacciones, o a otros rasgos propios
estructurales.
Un
ejemplo que ilustra bien la definición de elemento químico es el siguiente: los
isótopos 12C, 13C y 14C
son algunos de los isótopos del elemento químico carbono (C).
Los
elementos químicos están representados, clasificados y organizados en la Tabla Periódica de los
elementos.
¿Qué es una reacción química?
Las
reacciones químicas (también llamadas cambios químicos o fenómenos químicos) son procesos
termodinámicos de transformación de la materia. En estas reacciones
intervienen dos o más sustancias (reactivos
o reactantes), que cambian significativamente en el proceso, y pueden consumir
o liberar energía para
generar dos o más sustancias llamadas productos.
Toda
reacción química somete a la materia a una transformación química, alterando su
estructura y composición molecular (a diferencia de los cambios físicos que sólo
afectan su forma o estado de
agregación). Los cambios químicos generalmente producen sustancias
nuevas, distintas de las que teníamos al principio.
Las
reacciones químicas pueden darse de manera espontánea en la naturaleza (sin que
intervenga el ser humano), o también pueden ser generadas por el ser humano en
un laboratorio bajo condiciones controladas.
Muchos
de los materiales que empleamos a diario son obtenidos industrialmente a partir
de sustancias más simples combinadas mediante una o diversas reacciones
químicas.
¿Cómo se representa una reacción química?
Las
reacciones químicas se representan mediante ecuaciones químicas, es
decir, fórmulas en
las que se describen los reactivos participantes y los productos obtenidos, a
menudo indicando determinadas condiciones propias de la reacción, como la
presencia de calor, catalizadores, luz etc.
La
primera ecuación química de la historia fue redactada en 1615 por Jean Beguin, en uno de
los primeros tratados sobre química,
el Tyrocinium Chymicum. Hoy son de enseñanza común y gracias a
ellas podemos visualizar con mayor facilidad lo que está ocurriendo en una
reacción determinada.
La
forma general de representar una ecuación química es:
Tipos y ejemplos de reacciones químicas
Las
reacciones químicas pueden clasificarse según el tipo de reactivos que
reaccionan. En base a esto, se pueden distinguir reacciones químicas
inorgánicas y reacciones químicas orgánicas. Pero antes, es importante
conocer algunos de los símbolos que se utilizan para representar dichas
reacciones mediante ecuaciones químicas:
Reacciones
inorgánicas. Involucran compuestos inorgánicos, y
pueden ser clasificadas de la siguiente forma:
- Según el
tipo de transformación.
- Reacciones
de síntesis o adición. Dos sustancias se combinan
para dar como resultado una sustancia diferente. Por ejemplo:
- Reacciones
de descomposición. Una sustancia se descompone en sus
componentes simples, o una sustancia reacciona con otra y se descompone
en otras sustancias que contienen los componentes de esta. Por ejemplo:
- Reacciones
de desplazamiento o sustitución. Un compuesto o elemento
ocupa el lugar de otro en un compuesto, sustituyéndolo y dejándolo libre.
Por ejemplo:
- Reacciones
de doble sustitución. Dos reactivos intercambian compuestos
o elementos químicos simultáneamente.
Por ejemplo:
- Según el tipo
y la forma de la energía intercambiada.
- Reacciones
endotérmicas. Se absorbe calor para que la reacción
pueda ocurrir. Por ejemplo:
- Reacciones exotérmicas. Se
desprende calor cuando la reacción ocurre. Por ejemplo:
- Reacciones
endoluminosas. Se
necesita luz para que
ocurra la reacción. Por ejemplo: la fotosíntesis.
- Reacciones
exoluminosas. Se
desprende luz cuando ocurre la reacción. Por ejemplo:
- Reacciones
endoeléctricas. Se
necesita energía
eléctrica para que la reacción ocurra. Por ejemplo:
- Reacciones
exoeléctricas. Se
desprende o se genera energía eléctrica cuando ocurre la reacción. Por
ejemplo:
- Según la
velocidad de reacción.
- Reacciones
lentas. La
cantidad de reactivos consumidos y la cantidad de productos formados en
un tiempo determinado es muy poca. Por ejemplo: la oxidación del hierro.
Es una reacción lenta, que vemos cotidianamente en los objetos de hierro
que están oxidados. Si no fuese lenta esta reacción, no tendríamos
estructuras de hierro muy antiguas en el mundo actual.
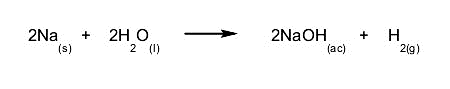
- Reacciones
rápidas. La
cantidad de reactivos consumidos y la cantidad de productos formados en
un tiempo determinado es mucha. Por ejemplo: la reacción del sodio con el
agua es una reacción que además de ocurrir rápidamente es muy peligrosa.
- Según el
tipo de partícula involucrada.
- Reacciones ácido-base. Se
transfieren protones (H+).
Por ejemplo:
- Reacciones
de oxidación-reducción. Se transfieren electrones. En este tipo de
reacción debemos fijarnos en el número de oxidación de los elementos
involucrados. Si el número de oxidación de un elemento aumenta, este se
oxida, si disminuye, este se reduce. Por ejemplo: en esta reacción se
oxida el hierro y se reduce el cobalto.
- Según el
sentido de la reacción.
- Reacciones
reversibles. Se
dan en ambos sentidos, es decir, los productos pueden volver a
convertirse en los reactivos. Por ejemplo:
- Reacciones
irreversibles. Se
dan en un solo sentido, es decir, los reactivos se transforman en
productos y no puede ocurrir el proceso contrario. Por ejemplo:
Reacciones
orgánicas. Involucran
compuestos orgánicos, que son los que están relacionados con la base de la
vida. Dependen del tipo de compuesto orgánico para su clasificación, ya que
cada grupo funcional posee un rango de reacciones específicas. Por ejemplo, los
alcanos, alquenos, alquinos, alcoholes,
cetonas, aldehídos, éteres, ésteres, nitrilos, etc.
Algunos
ejemplos de reacciones de compuestos orgánicos son:
- Halogenación
de alcanos. Se
sustituye un hidrógeno del alcano por el halógeno correspondiente.
- Combustión
de alcanos. Los
alcanos reaccionan con el oxígeno para dar dióxido de carbono y
agua. Este tipo de reacción libera gran cantidad de energía.
- Halogenación
de alquenos. Se
sustituyen dos de los hidrógenos presentes en los carbonos que forman el
doble enlace.
- Hidrogenación
de alquenos. Se
agregan dos hidrógenos al doble enlace, de esta forma se produce el alcano
correspondiente. Esta reacción ocurre en presencia de catalizadores como
platino, paladio o níquel.