TEMA
3: Experimentación con mezclas: • Homogéneas y
heterogéneas. • Métodos de separación de mezclas con base en las propiedades
físicas de sus componentes.
Aprendizaje
esperado: • Identifica los
componentes de las mezclas y las clasifica en homogéneas y heterogéneas. •
Identifica la relación entre la variación de la concentración de una mezcla
(porcentaje en masa y volumen) y sus propiedades. • Deduce métodos de
separación de mezclas con base en las propiedades físicas de sus componentes.
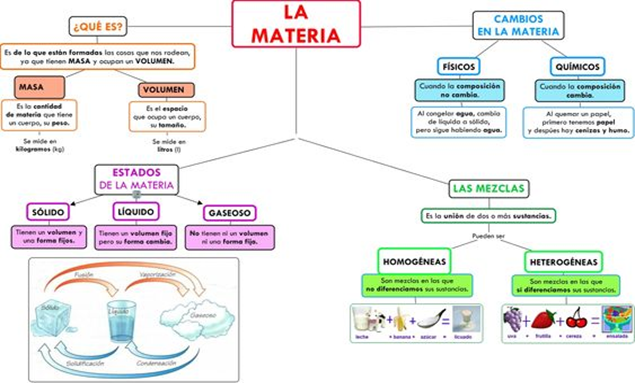
En química, una mezcla es la combinación de dos o más sustancias puras que se juntan sin cambiar químicamente. Por esta razón, es posible separar a los componentes de las mezclas mediante ciertos procedimientos físicos, como la filtración o la destilación. Por ejemplo: agua y arena, café con azúcar, aceite en agua.
Una mezcla se compone por una o más sustancias en composición variable. Hay dos tipos de mezclas: heterogéneas y homogéneas. Las mezclas heterogéneas tienen componentes que se distinguen a simple vista, mientras que las mezclas homogéneas parecen ser completamente uniforme.
Las mezclas se clasifican atendiendo a qué tan factible sea identificar a simple vista sus distintos componentes.
- Las mezclas homogéneas. Son aquellas en que los componentes no pueden distinguirse. Se conocen también como soluciones, y se conforman por un solvente y uno o varios solutos. Y como hemos dicho, las fases son imposibles de identificar a simple vista.
- Las mezclas heterogéneas. Son aquellas en que los componentes pueden distinguirse con facilidad, debido a que poseen una composición no uniforme, o sea, sus fases se integran de manera desigual e irregular, y por eso es posible distinguir sus fases con relativa facilidad. Dependiendo del tamaño de las partículas de sus componentes, podemos hablar de dos tipos de mezclas heterogéneas:
Ejemplos de mezclas homogéneas
- El aire. El gas común que respiramos a diario, es una mezcla de sustancias puras gaseosas (como oxígeno, nitrógeno y argón, entre otras más) que son imposibles de percibir a simple vista y que, en conjunto, suelen ser inodoras.
- Las bebidas alcohólicas. Como los cócteles, consisten en dos o más líquidos (o incluso sólidos) mezclados hasta adquirir una apariencia uniforme y, aunque podamos saborear sus integrantes, no podríamos señalarlos a simple vista.
- El agua con azúcar. Que solemos darle a las personas que se descompensan, es una dilución de un sólido (azúcar) en un líquido (agua), al punto tal de que no puede apreciarse la diferencia.
- Las aleaciones metálicas. Como el acero inoxidable del que están hechos algunos cuchillos, se obtienen mezclando el hierro con carbono y otros componentes metálicos, para que la mezcla adquiera la combinación de sus propiedades. Para ello se los debe fundir hasta el estado líquido, luego mezclarlos y dejarlos solidificar.
- Las amalgamas. Tal como las usaba antiguamente el dentista, solían ser una mezcla de mercurio y algún otro metal, convertidos en una pasta uniforme y maleable, que luego endurecía al solidificar.
- La espuma de afeitar. Es una mezcla de agua, jabones, glicerina y mentol, a menudo acompañada de gases (si viene en spray).
- La sangre. Es también una mezcla homogénea de un número inmenso de compuestos líquidos, sólidos y gaseosos, que apreciamos simplemente como un líquido rojo más o menos espeso.
Ejemplos de mezclas heterogéneas
- Los aerosoles. Como los desodorantes o la pintura en spray, se componen de una mezcla de líquido y gas, que son eyectados del envase al mismo tiempo, pero que luego el gas se dispersa y el líquido queda sobre la superficie rociada. Se trata de una mezcla coloidal.
- La grava o gravilla. Es una mezcla de dos o más tipos de piedra en pedazos pequeños, que pueden distinguirse a simple vista. Es un caso de dispersión gruesa.
- Una ensalada. Es otro perfecto ejemplo de dispersión gruesa, ya que podemos apreciar cada uno de sus componentes a simple vista pero funcionan todos en conjunto: vegetales, aceite, frutos, a veces carnes, etc.
- El agua y aceite. Es también un ejemplo de mezcla heterogénea en la que podemos identificar ambas fases, aunque en este caso se trata de una suspensión líquido-líquido.
- Algunos medicamentos. En cuyos empaques se nos sugiere que los agitemos antes de usar, son casos de suspensiones en las que el sólido se precipita al fondo con el tiempo, y por eso debemos agitarlo para que vuelva a disolverse, haciéndose temporalmente inapreciable la distinción entre uno y otro.
- El hormigón. Es una mezcla de agua, arena y cemento en proporciones específicas que, una vez solidificada y desecada, adquiere su dureza y uniformidad.
Sustancias puras
Las sustancias puras son aquellas que no son el resultado de una mezcla, sino que están compuestas por una única fase y, por lo tanto, no pueden ser separadas en sus componentes mediante métodos físicos. Además, presentan una composición química estable y son químicamente uniformes.
Una sustancia pura no necesariamente tiene que estar compuesta por un único tipo de elemento químico. Las sustancias puras pueden clasificarse en:
- Sustancias simples. Son aquellas compuestas por un único tipo de elemento químico (lo cual no quiere decir que estén compuestas por un solo átomo). Por ejemplo: el oxígeno (O2), el níquel (Ni).
- Sustancias compuestas. Son aquellas compuestas por más de un tipo de elemento químico. Por ejemplo: el agua (H2O), el dióxido de carbono (CO2).
La única forma de separar los elementos de una sustancia pura es utilizando métodos químicos, es decir, transformándola en otras sustancias o directamente en sus elementos químicos.
Es necesario aclarar que la pureza absoluta no existe. En el mundo en que vivimos las sustancias existen en la naturaleza en forma de ciertas mezclas, o dicho de otra manera, con cierto nivel de impurezas. No obstante, las impurezas se pueden separar hasta lograr el grado de pureza deseado o permitido de la sustancia.
Ejemplos de sustancias puras: cobre (Cu), plata (Ag), oro (Au), glucosa (C6H12O6), oxígeno (O2), agua (H2O).
¿Qué es una disolución?
Una disolución es una mezcla homogénea formada por dos o más sustancias puras que no reaccionan químicamente entre sí. Una de estas sustancias es el disolvente y la otra (o las otras) es el soluto. La distinción entre soluto y solvente es un poco arbitraria, pero por lo general se toma el soluto como el componente que está en menor cantidad y el solvente como el componente que está en mayor cantidad en la disolución.
El resultado obtenido, de hecho, depende en gran medida de la concentración de soluto y especialmente de su coeficiente de solubilidad (cantidad necesaria de una sustancia para saturar cierta cantidad de solvente) en el solvente (algunas sustancias se disuelven mejor en otras).
Las disoluciones se clasifican según el estado de agregación de sus componentes, en:
- Cuando el soluto y el disolvente son sólidos. Disoluciones de sólido en sólido. Las aleaciones son un ejemplo de este tipo de disolución. Por ejemplo: el bronce es una aleación de cobre (Cu) y estaño (Sn).
- Cuando el soluto es un sólido y el disolvente es un líquido. Disoluciones de sólido en líquido. Son probablemente las más empleadas en todas las ramas de la química y otros rubros. Por ejemplo: una disolución de agua con sal.
- Cuando el soluto es un sólido y el disolvente es un gas. Disoluciones de sólido en gas. Por ejemplo: el polvo disuelto en el aire.
- Cuando el soluto es un líquido y el disolvente es un sólido. Disoluciones de líquido en sólido. Por ejemplo: las amalgamas son una disolución de mercurio líquido y plata sólida, o mercurio y otros metales.
- Cuando el soluto es un líquido y el disolvente es un líquido. Disoluciones de líquido en líquido. Son también muy empleadas en todos los rubros de la química, la medicina y la industria en general. Por ejemplo, una disolución de etanol en agua.
- Cuando el soluto es un líquido y el disolvente es un gas. Disoluciones de líquido en gas. Por ejemplo: el aire o algún otro gas húmedo.
- Cuando el soluto es un gas y el disolvente es un sólido. Disolución de un gas en sólido. Por ejemplo: disolución de hidrógeno en algunos metales.
- Cuando el soluto es un gas y el disolvente es un líquido. Disolución de un gas en líquido. Por ejemplo: el oxígeno disuelto en agua, que permite la respiración de los peces.
- Cuando el soluto es un gas y el disolvente es un gas. Disolución de un gas en gas. Por ejemplo: el gas natural es una disolución gaseosa de metano, etano, propano, butano, dióxido de carbono y otros gases en pequeñas proporciones.
Las disoluciones tienen dos componentes diferentes:
- Disolvente. El disolvente es la sustancia en la que se disuelve el soluto, generalmente es la más predominante. También se le conoce como solvente, dispersante o medio de dispersión.
- Soluto(s). En este caso hablamos de la sustancia que es disuelta por el disolvente. Una misma disolución puede tener más de un soluto disuelto en en el mismo disolvente. El soluto se encuentra en menor cantidad que el disolvente.
Propiedades de una disolución
Los componentes de una disolución no pueden ser reconocidos a simple vista. Tampoco pueden ser separados por centrifugación, ni filtración, sino por métodos fraccionarios de separación de fases, como son la evaporación, la destilación o la cristalización.
Esto se debe a que se trata de una mezcla homogénea, en la que no se dan reacciones químicas, pero sí se obtiene un resultado distinto en apariencia y propiedades físicas a sus sustancias antecesoras.
Su comportamiento físico es distinto al de sus componentes por separado pero, por el contrario, dejan sin alterar las propiedades químicas de cada uno.
Tal como en otras mezclas, podemos también obtener diversos tipos de disoluciones (y con ellas, distintos comportamientos) a través de la concentración final del soluto en el solvente, pudiendo así hablar de:
- Disoluciones diluidas. Poco soluto en la misma cantidad de disolvente.
- Disoluciones concentradas. Abundante soluto en la misma cantidad de disolvente.
- Disoluciones saturadas. Logran el equilibrio entre soluto y disolvente, sin que se pueda añadir más soluto, al menos en ciertas condiciones dadas de temperatura y presión.
- Disoluciones sobresaturadas. Son disoluciones que contienen más soluto del que tendría la disolución saturada a cierta temperatura y presión. Si se aumenta la temperatura de una disolución saturada, es posible agregar más soluto, pero si se deja enfriar lentamente, se puede transformar en una disolución sobresaturada.
¿Qué es compuesto?
En química se llama compuesto a una sustancia que está formada por dos o más elementos de la tabla periódica. La palabra compuesto proviene del latín composĭtus. Podemos hablar de que algo está “compuesto de” para señalar qué cosas conforman algo.
Los compuestos químicos tienen una fórmula química. Un compuesto químico está conformado por moléculas o iones que están enlazados de forma estable. Los elementos químicos que conforman un compuesto químico no pueden separarse con ningún tratamiento o proceso físico, sino solo con algún método químico.
No debe confundirse un compuesto químico con una mezcla (material formado por dos o más componentes no combinados químicamente) o una aleación (mezcla de dos o más componentes donde al menos uno es un metal). Los componentes de una mezcla o de una aleación se pueden separar utilizando métodos físicos de separación como la filtración, la destilación, la decantación y la evaporación.

Los métodos de separación de
mezclas son aquellos procesos físicos por los cuales se pueden separar las
mezclas. Por lo general,
el método
a utilizar se define de acuerdo a los tipos de componentes de la mezcla y a las
propiedades esenciales, así
como las preferencias más importantes entre las fases.
Evaporación: Es un método físico que permite
separar un sólido de un líquido en una mezcla homogénea. Se basa en que el
punto de fusión del sólido es mayor al punto de ebullición del líquido. Se
utiliza cuando no hay interés en el líquido que se evapora, ya que este no se
recupera, pasa a formar parte del medio. Esta operación se emplea para separar
la sal del agua de mar en las salinas. El agua de mar almacenada en tanques
abiertos se evapora poco a poco por los rayos de sol.
Cristalización.
Este método se
utiliza para separar una mezcla de un sólido en un líquido. La mezcla se
calienta para evaporar parte del disolvente. Posteriormente se deja enfriar la
mezcla y el soluto se precipita formando cristales. Se utiliza para separar el
azúcar del agua en una disolución azucarada. No se puede separar por
evaporación, ya que el punto de fusión del azúcar es menor al punto de
ebullición del agua y lo que se obtiene es un caramelo y no la separación de
separación de las sustancias puras.
Destilación.
Este método
consiste en separar dos o más líquidos miscibles con diferentes puntos de
ebullición, primero por medio de la evaporación posteriormente por la
condensación de las sustancias. A través de esta operación se separan
principalmente mezclas homogéneas de líquidos. Este método se utiliza para
separar a las diferentes fracciones del petróleo. Por este procedimiento
también puede separarse una mezcla de un sólido en un líquido, con la ventaja
de que se pueden recuperar tanto el líquido como el sólido, a diferencia de la
evaporación.
Cromatografía.
Este método
depende de la distribución de los componentes de la mezcla entre dos fases
inmiscibles. Una fase móvil, llamada activa, que transporta las sustancias que
se separaron y que progresa en relación con otra, denominada fase estacionaria.
Por ejemplo, por esta técnica se pueden separar los componentes de la tinta de
pluma o de un plumón..
Sedimentación.
Es una
operación basada en la diferencia de densidades de los componentes de la
mezcla, que permite separar mezclas heterogéneas de un sólido en un líquido
mediante reposo o precipitación. Es el paso previo a la decantación. Se usa,
por ejemplo, para separar arena de agua. Se deja reposar y las partículas más
grades de arena se van al fondo del recipiente (precipitan), es a lo que se le
llama sedimento.
Decantación.
Se utiliza
para separar dos líquidos con diferentes densidades o una mezcla constituida
por un sólido insoluble en un líquido. Se trata de un método basado en la
diferencia por densidades. Si tenemos una mezcla de sólido y un líquido que no
disuelve dicho sólido, se deja reposar la mezcla y el sólido se va al fondo del
recipiente. Si se trata de dos líquidos se coloca la mezcla en un embudo de
decantación, se deja reposar y el líquido más denso queda en la parte inferior
del embudo.
Filtración.
Se trata de
una operación que permite separar mezclas heterogéneas de un sólido insoluble
en un líquido. Se hace pasar la mezcla a través de un papel filtro, el sólido
se quedará en la superficie del papel y el otro componente pasará. Es posible
separar sólidos de partículas sumamente pequeñas. Utilizando papeles con el
tamaño de los poros adecuados. Es uno de los métodos más simples de separación
física, además de ser sencillo y barato. Seguramente lo has usado, al colar en
la cocina algún elemento.
Centrifugación.
Se trata de
una operación que consiste en la separación de materiales de diferentes
densidades que componen una mezcla. Para eso se coloca la mezcla dentro de un
aparato llamado centrífuga que tiene un movimiento de rotación constante y
rápido, lo cual hace que las partículas de mayor densidad vayan al fondo y las
más livianas queden en la parte superior. Observamos un ejemplo en las
lavadoras automáticas o semiautomáticas. Este método se usa con frecuencia en
Biología y Medicina para separar la grasa de la leche o el suero de los
glóbulos rojos y plaquetas de la sangre.
Imantación.
Consiste en
separar con un imán los componentes de una mezcla de un material magnético y
otro que no lo es. La separación se hace pasando el imán a través de la mezcla
para que el material magnético se adhiera a él. Por ejemplo, separar las
limaduras de hierro (magnético) que se hallen mezcladas con azufre en polvo (no
magnético), para lo cual basta con mantener con un imán el componente
magnético.