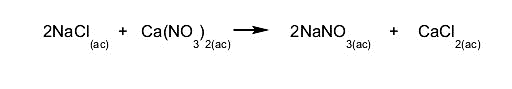¿POR QUÉ SE DEBE EVITAR EL CONSUMO
FRECUENTE DE LOS ALIMENTOS ÁCIDOS?
Aprendizajes Esperados: • Identifica la acidez de algunos alimentos o de aquellos que la provocan.• Identifica las propiedades de las sustancias que neutralizan la acidez estomacal.• Analiza los riesgos a la salud por el consumo frecuente de alimentos ácidos, con el fin de tomar decisiones para una dieta correcta que incluya el consumo de agua simple potable.
¿Qué es una alimentación saludable?
la
alimentación saludable es aquella que proporciona los nutrientes que el cuerpo
necesita para mantener el buen funcionamiento del organismo, conservar o
restablecer la salud, minimizar el riesgo de enfermedades, garantizar la
reproducción, gestación, lactancia, desarrollo y crecimiento adecuado. Para lograrlo, es necesario el consumo diario de frutas, verduras,
cereales integrales, legumbres, leche, carnes, aves y pescado y aceite vegetal
en cantidades adecuadas y variadas. Si lo hacemos así, estamos diciendo que
tenemos una alimentación saludable.
Dentro de los alimentos ácidos encontramos
los arándanos, la ciruela pasa, los jugos procesados de frutas, las papas,
el chocolate, el maíz, la avena, el arroz, los quesos procesados, la
mantequilla de maní, la cerveza, el alcohol, el vino, los fideos, los
macarrones, las drogas químicas y los edulcorantes artificiales, entre
otros. el exceso de acidez en la alimentación puede destruir los huesos,
provocar acné, dolor muscular, baja energía, ataques de pánico, falta de deseo
sexual, sabor metálico en la boca, enfermedades por hongos, gastritis, colitis,
caída excesiva del cabello, esquizofrenia y cáncer, entre otras enfermedades.
por eso se debe evitar el consumo frecuente de los alimentos ácidos. Pero esto
no significa que todos los alimentos ácidos se deban evitar, el cuerpo necesita
mantener un equilibrio entre lo ácido y lo alcalino.
El PH o potencial de Hidrógeno que muestra el grado
de alcalinidad o acidez de una solución. Un pH por debajo de 7,0 es ácido
mientras que un pH por encima de 7,0 es alcalino.
Un desequilibrio ácido puede:
- reducir la capacidad del cuerpo para absorber
los minerales y otros nutrientes
- reducir la producción de energía en las células
- reducir capacidad para reparar las células
dañadas
- reducir a capacidad del cuerpo para
desintoxicar los metales pesados
- permitir que las células tumorales crezcan
El exceso
de acidez en la alimentación puede destruir los huesos, provocar acné,
dolor muscular, baja energía, ataques de pánico, falta de deseo sexual, sabor
metálico en la boca, enfermedades por hongos, gastritis, colitis, caída
excesiva del cabello, esquizofrenia y cáncer, entre otras enfermedades. Por eso
se debe evitar el consumo frecuente de los alimentos ácidos.
¿Qué
es la acidez en los alimentos?: El valor
del pH indica si una sustancia es ácida, alcalina o neutra. De esta manera,
cuando el valor del pH de una sustancia se encuentre entre 0 y 7, ésta
se considera ácida. Por otro lado, cuando el valor del pH de una
sustancia es mayor que 7 e inferior que 14, se considera alcalina.
¿Por
qué evitar los alimentos ácidos?: Así como
diferentes sustancias tienen diferentes niveles de pH, diferentes partes del
cuerpo también los tienen. De este modo, el pH ideal en la sangre debe
encontrarse entre 7.35 y 7.45 (ligeramente alcalino). Pero, el pH del
estómago debe situarse en 3.5, ya que la acidez ayuda a descomponer
las moléculas de los alimentos con más facilidad.
¿Cómo
se puede neutralizar la acidez estomacal?
Un antiácido es una sustancia,
generalmente una base (medio alcalino), que actúa en contra de
la acidez estomacal (ácidos generados por las glándulas parietales).
Los antiácidos más conocidos son el bicarbonato
sódico (NaHCO3), el carbonato cálcico (CaCO3)
y el hidróxido de magnesio (Mg(OH)2) o de aluminio.
Los antiácidos son bases débiles, por lo que
desarrollan básicamente un mecanismo de reacciones
de neutralización al reaccionar con el ácido estomacal y formar agua
y una sal.
Los antiácidos sirven para contrarrestar el exceso de acides estomacal,
por lo que son sustancias básicas.
ALIMENTOS
QUE SE DEBEN DE COMER
Nuestro cuerpo necesita una serie de compuestos
químicos para obtener la energía que necesita, para formar o reparar tejidos
y para llevar a cabo los complicados procesos bioquímicos que suceden en
nuestro interior. para poder disponer de esos nutrientes, debemos obtenerlos de
los alimentos que ingerimos. los nutrientes no están simplificados en los
alimentos, sino que el organismo debe descomponerlos para asimilarlos en forma
de moléculas sencillas. las cantidades que necesitamos de esos nutrientes son diferentes,
como también lo son las cantidades que obtenemos de los distintos alimentos.
LAS
PROTEÍNAS: Las proteínas son el principal componente del que
están hechos nuestros tejidos y algunas de las principales moléculas
reguladoras (enzimas, hormonas, etc). es decir, nuestros cuerpos están
compuestos fundamentalmente de proteínas. Las proteínas son macromoléculas muy
complejas creadas a partir de la unión de otras moléculas más sencillas
llamadas aminoácidos. cuando ingerimos proteínas, nuestro organismo las
descompone en aminoácidos que utiliza para crear sus propias proteínas (y con
ellas los tejidos, las enzimas, las hormonas, etc.
CARBOHIDRATOS: O hidratos de carbono, también llamados glúcidos (o azúcares) son la
principal fuente de energía del organismo. es decir, es el alimento con que se
nutren nuestras células. se trata de moléculas formadas por unidades de
carbono, hidrógeno y oxígeno. Los carbohidratos son descompuestos a través de
enzimas digestivas específicas que se encargan de transportarlos hasta la
sangre o hasta el hígado, donde se almacena en forma de glucógeno para ser
lanzado al torrente sanguíneo cuando es preciso. el cerebro es el principal
consumidor de glucosa y el índice glucémico (nivel de azúcar) que debemos tener
en sangre es muy específico y delicado. por eso lo más saludable es consumir
preferiblemente azúcares compuestos de absorción lenta como vegetales, cereales
integrales y legumbres. La fibra es un tipo de carbohidrato que nuestro cuerpo
no puede digerir. sin embargo, juega un importante papel en la flora intestinal
y da consistencia a las heces favoreciendo el tránsito intestinal y evitando el
estreñimiento.
LAS
GRASAS: Las grasas (o lípidos) son diferentes tipos de
sustancia que tienen como característica común que no pueden diluirse en agua.
Su principal función dentro del organismo es servir como reserva energética,
pero además forman parte de las membranas celulares, mantienen la temperatura
corporal, protegen órganos vitales como el corazón, transportan vitaminas
liposolubles y ayudan en la síntesis de vitaminas y hormonas, entre otras
funciones.
LAS
VITAMINAS: Las vitaminas son nutrientes que el organismo
necesita en cantidades muy pequeñas. no suponen una fuente de energía, pero las
vitaminas son imprescindibles para realizar numerosas reacciones metabólicas y
su carencia provoca enfermedades graves.
LOS
MINERALES: El ser humano los necesita para mantener el
buen funcionamiento del cuerpo y garantizar, entre otros, la
formación de los huesos, la regulación del ritmo cardiaco y
la producción de las hormonas.
Las funciones de cada uno de los macrominerales son.
- Los minerales que aportan calcio,
uno de los responsables en la formación de los dientes y de los huesos,
están presentes fundamentalmente en los lácteos y los derivados lácteos.
Además, también podemos encontrar el calcio en hortalizas de hojas verdes,
como el repollo, el brócoli, la col rizada, los nabos o la berza común, el
salmón, las sardinas, frutos secos como las almendras o las semillas de
girasol y legumbres secas, entre otros productos.
- En el caso del magnesio, uno de los
macroelementos que participa en la actividad de muchas enzimas, se puede
encontrar principalmente en vegetales, en frutas como el albaricoque o en
frutos secos, uno de los grupos de alimentos que más magnesio contienen.
- El fósforo es otro de los
macroelementos que participa en la formación de los dientes y los huesos
junto con el calcio. Se puede obtener principalmente en productos
proteícos como la carne y la leche.
- El potasio participa en la
comunicación entre los nervios y los músculos. Principalmente puede
obtenerse de verduras como las espinacas, de las uvas o las moras, de las
zanahorias, los plátanos, las patatas y las naranjas.
- El azufre participa en la
síntesis del colágeno e interviene en el metabolismo de los lípidos, entre
otras funciones. El queso, las legumbres, la cebolla, el ajo, los frutos
secos, la carne roja y las legumbres son los alimentos que lo contienen.
- El cloro ayuda a mantener el
equilibrio de los líquidos corporales. La principal fuente de la que lo
obtiene el ser humano es de la sal de cocina y de verduras como las algas
marinas o la lechuga. Los tomates, las aceitunas, el centeno y el apio son
algunos de los alimentos que también contienen niveles altos de apio.
- Al igual que el potasio, el sodio ayuda
en las funciones de los nervios y los músculos y junto con el cloro, en el
mantenimiento del equilibrio de los líquidos corporales. La mayor fuente
de sodio es el cloruro de sodio, más conocido como sal común.
- Entre otras funciones, el hierro participa
en el transporte de oxígeno y su déficit puede provocar anemia. Se
encuentra principalmente en la carne roja, las legumbres, el salmón, el
atún, las frutas deshidratadas, los huevos, las ostras o los cereales,
entre otros alimentos.
- El manganeso es imprescindible para el
buen funcionamiento del organismo. Las nueces, el té, las legumbres, las
semillas, las verduras de hoja verde y los cereales integrales son la
principal fuente natural de este oligoelemento.
- La formación de los glóbulos rojos está
vinculada con el cobre. Este mineral se puede obtener del marisco,
las legumbres, las nueces, las patatas, las verduras de hoja verde y las
frutas deshidratadas, entre otros.
- El selenio participa en actividades como
la reproducción la regulación de la hormona tiroidea. Al igual que otros
oligoelementos, está disponible en la carne, la leche y sus derivados, el
pan y los cereales y el marisco.
- El yodo participa en la producción de
las hormonas tiroideas y ejerce un papel fundamental durante el embarazo.
Las personas pueden obtenerlo de pescado como el atún o el bacalao, del
marisco, los lácteos, los cereales, la sal común y algunas frutas y
vegetales.
- El cobalto actúa para estimular y
conseguir el buen funcionamiento de los glóbulos rojos. Se encuentra
fundamentalmente en almejas, pescados, quesos, carne roja, en cereales
integrales, en frutas como las peras, las cerezas, las legumbres y en
frutos secos como las avellanas y las nueces, entre otros.
- El cinc es uno de los oligoelementos que
ayuda a que el sistema autoinmune funcione de forma adecuada. Se encuentra
principalmente en la carne del cerdo y del cordero, en legumbres, levadura
y las nueces. Las frutas y las verduras no contienen tasas elevadas de
este mineral.
- El flúor interviene en la formación y en el fortalecimiento de los huesos y los dientes. Se encuentra en las aguas fluoradas, el té, el café, el pescado, el marisco y en vegetales como las espinacas o la col
- ¿Qué son las vitaminas?
Las vitaminas son sustancias que
ayudan al correcto funcionamiento del organismo de los seres
vivos pero que, en general, no son sintetizadas por su cuerpo,
es decir, deben obtenerse del exterior a través de la alimentación.
Se trata de nutrientes esenciales para el organismo,
cuya ausencia prolongada (avitaminosis) conduce a enfermedades y debilita el
organismo, pero cuyo exceso (hipervitaminosis) puede también ser perjudicial.
Sin embargo, la necesidad de vitaminas del organismo
es relativamente pequeña, pues suelen almacenarse en el cuerpo y se van
consumiendo paulatinamente. Las necesidades vitamínicas pueden satisfacerse
mediante una dieta más o menos balanceada, sobre todo incluyendo alimentos crudos
como frutos o vegetales, ya que algunas vitaminas se descomponen con facilidad
en el agua de
la cocción.
Vitamina
A. Se ocupa de mantener en buen estado los
dientes y tejidos óseos. Además, contribuye a mantener una buena visión, sumado
a una piel y mucosas sanas.
Vitamina
B2. Es un micronutriente necesario para muchos
procesos celulares. Es muy importante para el metabolismo energético y de
lípidos, carbohidratos y proteínas.
Vitamina
B3. Es muy importante para la reparación del ADN.
Vitamina
B5. Es esencial para la síntesis de carbohidratos,
proteínas y grasas.
Vitamina
B6. Forma parte de los procesos que regulan el
estado de ánimo y el sueño. Además, interviene en la síntesis de adrenalina y
dopamina. Aumenta el rendimiento muscular y la generación de energía en el
cuerpo. El cuerpo la necesita para producir glóbulos rojos y anticuerpos. Por
otra parte, se puede utilizar para aliviar las náuseas. Es muy importante para
que funcionen las células nerviosas y también forma parte del proceso de
síntesis de ADN y ARN.
Vitamina
B7. Es muy importante para los mecanismos de
degradación de grasas y algunos aminoácidos, aunque también interviene en la
síntesis de estos compuestos.
Vitamina
B9. Interviene en el proceso de maduración de
proteínas estructurales y la hemoglobina.
Vitamina
B12. Es imprescindible para que el cerebro
funcione correctamente. También interviene en el funcionamiento del sistema
nervioso, en la producción de la sangre y algunas proteínas.
Vitamina
D. Es fundamental en el metabolismo del calcio y
el fósforo, por lo que es muy importante en la formación y mantenimiento de
los huesos y
dientes.
Vitamina
E. Tiene un papel antioxidante fundamental en el
organismo humano y de los animales.
Vitamina
K. Juega un papel fundamental en la coagulación
de la sangre.