Cuando hablamos de estados de agregación o fases de la materia, nos referimos a las distintas
fases o formas en que es posible encontrar la materia conocida (sustancias puras o mezclas) y que dependen del tipo y la
intensidad de las fuerzas de atracción entre las partículas que componen
dicha materia (tales como átomos, moléculas, etc.).
Se conocen principalmente cuatro estados de agregación de la materia:
el estado sólido, el estado líquido, el estado gaseoso y el estado plasmático. También
existen otros menos frecuentes, como los condensados termiónicas, pero estas
formas no se producen naturalmente en el medio ambiente.
Cada uno de los estados de agregación posee características físicas
diferentes, como volumen,
fluidez o resistencia, a pesar
de que no exista una diferencia química real entre un estado y otro. Por
ejemplo, el agua sólida (hielo) y el agua líquida (agua) son químicamente idénticas.
Puede obligarse a la materia a pasar de un estado de agregación a otro,
tan solo alterando la temperatura
y la presión en las que se
encuentra. Así, se puede hervir agua líquida para llevarla al estado gaseoso (vapor) o se puede enfriar lo suficiente
como para llevarla al estado sólido (hielo).
Estos procedimientos de transformación de un estado de agregación de la
materia a otro suelen ser reversibles, aunque no sin cierto margen de pérdida
de la sustancia. Los procesos más
conocidos son los siguientes:
- Evaporación. Es
el proceso mediante el cual al introducir energía calórica (calor), parte de la masa de un
líquido (no necesariamente la totalidad de la masa) se transforma en gas.
- Ebullición o vaporización. Es
el proceso mediante el cual, al suministrar energía calórica, la totalidad
de masa de un líquido se transforma en un gas. La transición de fase
ocurre cuando la temperatura supera el punto de ebullición
del líquido (temperatura a la cual la presión del vapor del líquido se
iguala a la presión que rodea al líquido, por tanto, se convierte en
vapor).
- Condensación. Es
el proceso mediante el cual, al retirar energía calórica, un gas se
transforma en un líquido. Este proceso es contrario a la vaporización.
- Licuefacción. Es
el proceso mediante el cual, al aumentar mucho la presión, un gas se
transforma en un líquido. En este proceso, el gas también se somete a
bajas temperaturas, pero lo que lo caracteriza es la elevada presión a la
que es sometido el gas.
- Solidificación. Es
el proceso mediante el cual, al aumentar la presión, un líquido puede
transformarse en sólido.
- Congelación.
Es el proceso mediante el cual, al retirar energía calórica, un líquido se
transforma en sólido. La transición de fase ocurre cuando la temperatura
toma valores menores que el punto de congelación del líquido (temperatura
a la cual el líquido se solidifica).
- Fusión. Es el proceso
mediante el cual al suministrar energía calórica (calor), un sólido puede
transformarse en líquido.
- Sublimación. Es
el proceso mediante el cual, al suministrar calor, un sólido se transforma
en gas, sin pasar antes por el estado líquido.
- Deposición o sublimación inversa.
Es el proceso mediante el cual, al retirar calor, un gas se transforma
en sólido, sin pasar antes por el estado líquido.
¿Qué es una mezcla?
En química, una mezcla es
un material compuesto por dos o más componentes unidos físicamente, pero no
químicamente. Esto significa que no se produce entre ellos ninguna reacción química, es decir,
que cada componente mantiene su identidad y sus propiedades químicas, incluso
en el caso en que no podamos distinguir un componente del otro.
Los componentes o fases de una mezcla se hallan unidos mecánica o
físicamente. Por eso, a menudo se ven alteradas sus propiedades físicas,
como el punto de ebullición
o de fusión.
Sin embargo, al no producirse cambios químicos permanentes, es
posible emplear mecanismos
físicos de separación para extraer cada uno de los componentes de una
mezcla. Dichos mecanismos físicos suelen ser térmicos (cuando involucran calor) o mecánicos (cuando involucran el desplazamiento o el movimiento).
Las mezclas son formas mixtas de la materia sumamente frecuentes en la vida
cotidiana, y muchos de los materiales que usamos son el resultado de un
procedimiento de mezclado o mixtura. Los componentes de una mezcla pueden
hallarse en distintos estados de
agregación (sólidos, líquidos, gaseosos, plasmas, o combinaciones
entre ellos).
Tipos de mezclas
Las mezclas se clasifican atendiendo a qué tan factible sea identificar
a simple vista sus distintos componentes.
- Las mezclas homogéneas.
Son aquellas en que los componentes no pueden distinguirse. Se conocen
también como soluciones,
y se conforman por un solvente y uno o varios solutos. Y como hemos
dicho, las fases son imposibles de identificar a simple vista.
- Las mezclas heterogéneas.
Son aquellas en que los componentes pueden distinguirse con facilidad,
debido a que poseen una composición no uniforme, o sea, sus fases se
integran de manera desigual e irregular, y por eso es posible distinguir
sus fases con relativa facilidad. Dependiendo del tamaño de las partículas de sus
componentes, podemos hablar de dos tipos de mezclas heterogéneas:
- Mezclas
gruesas o dispersiones gruesas. Son aquellas en las que el tamaño de
las partículas es apreciable a simple vista.
- Suspensiones
o coloides. Son
aquellas en las que una fase es normalmente fluida (gaseosa o líquida) y
la otra está compuesta por partículas (generalmente sólidas) que quedan
suspendidas y se depositan al pasar el tiempo.
Ejemplos de mezclas homogéneas
Muchas bebidas alcohólicas son mezclas homogéneas.
A continuación, presentamos algunos ejemplos de mezclas homogéneas:
- El aire. El gas común que
respiramos a diario, es una mezcla de sustancias puras gaseosas (como
oxígeno, nitrógeno y argón, entre otras más) que son imposibles de
percibir a simple vista y que, en conjunto, suelen ser inodoras.
- Las bebidas
alcohólicas. Como los cócteles, consisten en dos o más líquidos
(o incluso sólidos) mezclados hasta adquirir una apariencia uniforme y,
aunque podamos saborear sus integrantes, no podríamos señalarlos a simple
vista.
- El agua con azúcar. Que
solemos darles a las personas que se descompensan, es una dilución de un
sólido (azúcar) en un líquido (agua), al punto tal de que no puede
apreciarse la diferencia.
- Las aleaciones
metálicas. Como el acero inoxidable del que están hechos algunos
cuchillos, se obtienen mezclando el hierro con carbono y otros componentes
metálicos, para que la mezcla adquiera la combinación de sus propiedades.
Para ello se los debe fundir hasta el estado líquido, luego mezclarlos y
dejarlos solidificar.
- Las
amalgamas. Tal como las usaba antiguamente el dentista, solían
ser una mezcla de mercurio y algún otro metal, convertidos en una pasta uniforme
y maleable, que luego endurecía al solidificar.
- La espuma de
afeitar. Es una mezcla de agua, jabones, glicerina y mentol, a menudo
acompañada de gases (si viene en spray).
- La sangre. Es
también una mezcla homogénea de un número inmenso de compuestos líquidos,
sólidos y gaseosos, que apreciamos simplemente como un líquido rojo más o
menos espeso.
Ejemplos de mezclas heterogéneas
La pintura en aerosol es una mezcla de líquido y gas.
Estos son algunos ejemplos de mezclas heterogéneas:
- Los
aerosoles. Como los desodorantes o la pintura en spray, se componen de
una mezcla de líquido y gas, que son eyectados del envase al mismo tiempo,
pero que luego el gas se dispersa y el líquido queda sobre la superficie
rociada. Se trata de una mezcla coloidal.
- La grava o
gravilla. Es una mezcla de dos o más tipos de piedra en pedazos
pequeños, que pueden distinguirse a simple vista. Es un caso de dispersión
gruesa.
- Una ensalada.
Es otro perfecto ejemplo de dispersión gruesa, ya que podemos apreciar
cada uno de sus componentes a simple vista pero funcionan todos en
conjunto: vegetales, aceite, frutos, a veces carnes, etc.
- El agua y aceite.
Es también un ejemplo de mezcla heterogénea en la que podemos
identificar ambas fases, aunque en este caso se trata de una suspensión
líquido-líquido.
- Algunos
medicamentos. En cuyos empaques se nos sugiere que los agitemos antes
de usar, son casos de suspensiones en las que el sólido se precipita al
fondo con el tiempo, y por eso debemos agitarlo para que vuelva a
disolverse, haciéndose temporalmente inapreciable la distinción entre uno
y otro.
- El hormigón.
Es una mezcla de agua, arena y cemento en proporciones específicas que,
una vez solidificada y desecada, adquiere su dureza y uniformidad.
Sustancias puras
Las sustancias puras son
aquellas que no son el resultado de una mezcla, sino que están compuestas
por una única fase y, por lo tanto, no pueden ser separadas en sus componentes mediante
métodos físicos. Además, presentan una composición química estable y son
químicamente uniformes.
Una sustancia pura no necesariamente tiene que estar compuesta por un
único tipo de elemento químico.
Las sustancias puras pueden clasificarse en:
- Sustancias
simples. Son aquellas compuestas por un único tipo de elemento químico
(lo cual no quiere decir que estén compuestas por un solo átomo). Por ejemplo: el oxígeno (O2),
el níquel (Ni).
- Sustancias
compuestas. Son aquellas compuestas por más de un tipo de elemento
químico. Por ejemplo: el agua (H2O),
el dióxido de
carbono (CO2).
La única forma de separar los elementos de una sustancia pura es
utilizando métodos químicos, es decir, transformándola en otras sustancias o
directamente en sus elementos químicos.
Es necesario aclarar que la pureza absoluta no existe. En el mundo en
que vivimos las sustancias existen en la naturaleza en forma de ciertas
mezclas, o dicho de otra manera, con cierto nivel de impurezas. No obstante,
las impurezas se pueden separar hasta lograr el grado de pureza deseado o
permitido de la sustancia.
Ejemplos de sustancias puras: cobre (Cu), plata (Ag), oro (Au), glucosa
(C6H12O6), oxígeno (O2), agua (H2O).
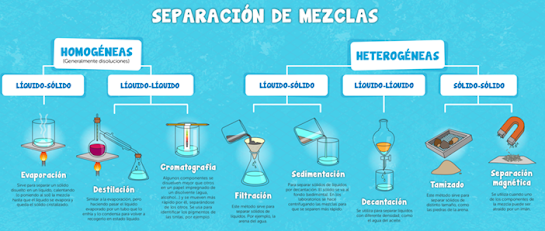
Métodos de separación de mezclas
Se conoce como métodos de separación de mezclas o métodos de
separación de fases a los distintos procedimientos físicos que
permiten separar dos o más componentes de una mezcla. Los componentes de la
mezcla conservan su identidad y sus
propiedades químicas luego de la separación.
Para que estos mecanismos funcionen, debe tratarse de mezclas
en que los componentes conserven su identidad, y no haya habido reacciones químicas que
alteren sus propiedades permanentemente o den origen a nuevas sustancias.
Para que puedan aplicarse los métodos de separación, las propiedades
como el punto de
ebullición, la densidad o el
tamaño deben conservarse en los componentes de la mezcla.
En cambio, estos métodos funcionan tanto en mezclas homogéneas como
en mezclas heterogéneas, ya que no suponen tampoco ningún cambio en la
identidad de los componentes, que pueden así recuperarse más o menos como
estaban antes de realizar la mezcla. Dependiendo del método aplicado, se lograrán los
componentes originales con mayor o menor pureza.
Decantación. La decantación es un método se emplea para separar líquidos que
no se disuelven el uno en el otro (como el agua y el aceite) o sólidos insolubles en
un líquido (como
agua y arena).
Consiste en el uso de una ampolla o un embudo de decantación,
donde se deja reposar la mezcla hasta que el ingrediente más denso sedimente y
vaya al fondo. Se abre la válvula y se lo deja salir, cerrándola a tiempo para
que permanezca el ingrediente menos denso en su interior. Este método suele
emplearse como primer paso hacia la obtención de sustancias más puras.
Filtración. La filtración es un método útil para separar sólidos no solubles de
líquidos. Consiste en la utilización de un filtro (papel filtrador, piedras
filtrantes, etc.) que permite el paso del líquido por un medio poroso y retiene
los elementos sólidos. Así operan los filtros de agua de
nuestras casas, o el papel de filtro donde vertemos el café sólido antes de
añadirle el agua caliente. El agua (que contiene las partículas más finas del
café) pasa a través del papel, y queda retenida en este las partículas más gruesas
del café.
Separación magnética. La separación magnética consiste en la separación de fases de
acuerdo a su potencial magnético. Algunas sustancias responden a los campos magnéticos y otras no, y
de acuerdo a esta diferencia se aplica un imán
o electroimán a la mezcla, que permite atraer un componente y dejar el otro
intacto (por ejemplo, fragmentos de hierro en tierra, mercurio en agua, trozos
de metal en agua).
Tamizado. El tamizado opera de manera
semejante al filtrado, pero entre sustancias sólidas de distinto
tamaño (como grava y arena, sal y palomitas de maíz, o arroz y piedritas). Se usa una red o tamiz, cuyos
agujeros permiten el paso de los fragmentos de menor tamaño y retienen los más
grandes. Dependiendo del material, puede emplearse como primer paso en la
obtención de sustancias puras o como paso definitivo.
Destilación. La destilación permite
separar líquidos solubles entre sí, pero que tengan distinto punto de
ebullición (como el agua y el alcohol). La diferencia entre los puntos de ebullición de los componentes a
separar por este método debe ser aproximadamente de 80 ºC.
El procedimiento consiste en
verter la mezcla en un recipiente y calentarla controlando la temperatura para que solo el componente de punto de
ebullición más bajo se evapore, y sea llevado a través de un conducto (llamado
columna de destilación) hacia otro recipiente, esta vez refrigerado. Allí se
condensará y volverá a su fase original. A los líquidos obtenidos así se
los conoce como destilados (agua destilada, alcohol destilado).
Cristalización. La cristalización es un método
ideal para separar sólidos disueltos en líquidos (sal en agua, azúcar en
agua). Consiste en evaporar el líquido hasta obtener en el fondo del recipiente
los cristales del sólido disuelto. Por ejemplo, así se obtiene la sal marina.
Dependiendo de la velocidad de la evaporación, los cristales serán más grandes o más
chicos.
Flotación. La flotación permite que la
fase sólida de menor densidad flote en el líquido. La flotación es el caso
contrario de la decantación y consiste en permitir que la fase sólida de
menor densidad flote en el líquido para luego retirarlo manualmente o
mediante un tamiz. El perfecto ejemplo de ello es el procedimiento de limpiado
de las piscinas.
Cromatografía. Es un método que se utiliza para separar
mezclas complejas que no responden a ningún otro método de separación. Emplea
la capilaridad como principio: proceso que permite el avance de una sustancia a
través de un medio específico. Se identifican así a las dos fases de la mezcla como
fase móvil (la que avanza) y fase estacionaria (sobre la que se avanza).
El funcionamiento de esta
separación depende de la afinidad de los componentes de la mezcla por ambas
fases, y de acuerdo a esta afinidad, la separación será más rápida o más lenta.
Por ejemplo, al derramar café sobre una tela, el café avanza ocupando una gran
cantidad de superficie.
En la actualidad existen
distintos métodos de cromatografía:
- Cromatografía de papel. La fase estacionaria se compone de una
tira de papel de filtro y la fase móvil está constituida por un disolvente
que contiene la muestra a separar. Se colocan unas gotas del disolvente
que contiene la muestra sobre un extremo del papel y se espera a que avance
el líquido. Luego se deja secar, y si los distintos componentes de la
muestra tienen colores diferentes, se podrá observar sus distintas
posiciones sobre el papel.
- Cromatografía de capa fina. La fase estacionaria está compuesta de
un material absorbente adherido a una placa que puede ser de vidrio,
aluminio u otro material. La fase móvil es un líquido que actuará como
eluyente. El procedimiento consiste en colocar la muestra sobre la placa y
luego sumergir en el eluyente una parte de esta. Los componentes se
separarán por diferencia de afinidad entre el eluyente y el componente
adherido a la placa.
- Cromatografía de columna. La fase estacionaria consiste en un
material sólido absorbente que se coloca como relleno en una columna de
vidrio (aunque en la actualidad existen columnas de otros materiales, por
ejemplo, acero inoxidable). La fase móvil se constituye de un eluyente y
la separación de los componentes de la muestra depende de la afinidad que
tienen sus componentes por ambas fases. Por lo general, el eluyente pasa a
través de la columna por gravedad, aunque se han desarrollado métodos
modernos donde es impulsado por bombas que aplican presión.
Actividad: En tu cuaderno realiza o imprime el siguiente mapa
Actividad: Con la
información que te sugiero en la parte superior contesta el siguiente
cuestionario
1.- ¿Qué entiendes
por mezcla?
2.- ¿Qué es una
sustancia pura?
3.- ¿Cómo se
clasifican las mezclas?
4.- Menciona las características de una mezcla
homogénea, y menciona ejemplos
5.- Menciona las
características de una mezcla heterogénea, y menciona ejemplos
6.- Cuales son los
métodos de separación que se emplean para las mezclas homogéneas
7.- Cuales son los
métodos de separación que se emplean para las mezclas heterogéneas
8.- A que llamamos en
química concentración
Actividad: Escribe sobre la línea la
palabra que complete la lectura, la información se encuentra en la parte
superior. (Nota puedes imprimir la hoja)
1._____________________________.
Es el proceso mediante el cual al introducir energía calórica (calor), parte de la masa de un líquido (no necesariamente
la totalidad de la masa) se transforma en gas.
2.___________________________.
Es el proceso mediante el cual, al retirar energía calórica, un gas se
transforma en un líquido.
3.___________________________.
Es el proceso mediante el cual, al aumentar mucho la presión, un gas se
transforma en un líquido.
4.___________________________.
Son aquellas en que los componentes no pueden distinguirse. Se conocen también
como soluciones, y se
conforman por un solvente y uno o varios solutos.
5.___________________________.
Son aquellas en que los componentes pueden distinguirse con facilidad, debido a
que poseen una composición no uniforme, o sea, sus fases se integran de manera
desigual e irregular.
6.___________________________.
son aquellas que no son el resultado de
una mezcla, sino que están compuestas por una única fase y, por lo
tanto, no pueden ser separadas en sus componentes mediante métodos físicos.
7.___________________________.
método se emplea para separar
líquidos que no se disuelven el uno en el otro (como el agua y el
aceite) o sólidos insolubles en un líquido (como agua y arena).
8.__________________________.
Es un método útil para separar sólidos
no solubles de líquidos.
9.__________________________. permite separar
líquidos solubles entre sí, pero que tengan distinto punto de ebullición.
10._________________________. Es un método ideal para
separar sólidos disueltos en líquidos (sal en agua, azúcar en agua).
11._________________________. Es un método que se utiliza
para separar mezclas complejas que no responden a ningún otro método de
separación.